Excerpt aus Patentschrift: "Methode zur Generierung selbstorganisierender Prozesse für autonome Mechanismen und Organismen"
US 6172941 (angemeldet: 16 12 1999,
erteilt 2001) siehe: Google Patents !
EP 1146406A1 (angemeldet: 03 12 1999)
Autor: Erich Bieramperl, 4040 Linz, Österreich
Zunächst die Grundlagen der im
Gehirn stattfindenden Zeitquantisierungs- und Analyseprozesse anhand
folgender Zeichnungen und Beschreibungen:
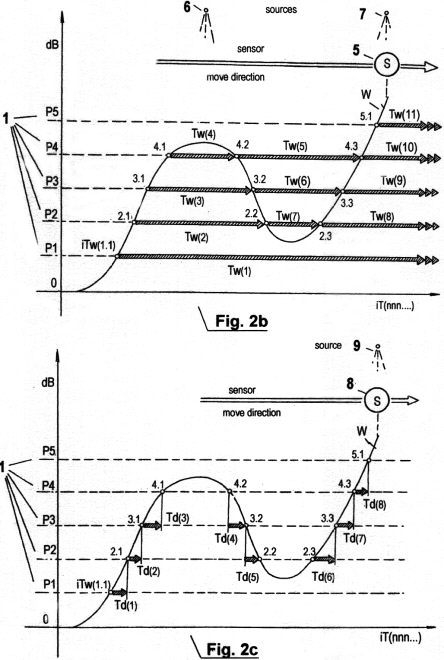
Fig. 2b und 2c zeigen grafische
Diagramme der Quantisierung von Signalamplituden mittels der
Erfassung von STQ(v), STQ(i) und STQ(d)-Verstreichzeiten wie sie das
Gehirn erfasst, speichert und analysiert. Im Gehirn werden
ausschliesslich Zeitdaten bzw. „zeitlicher Code“ verabeitet, keine
umgewandelten Daten oder Messwerte!
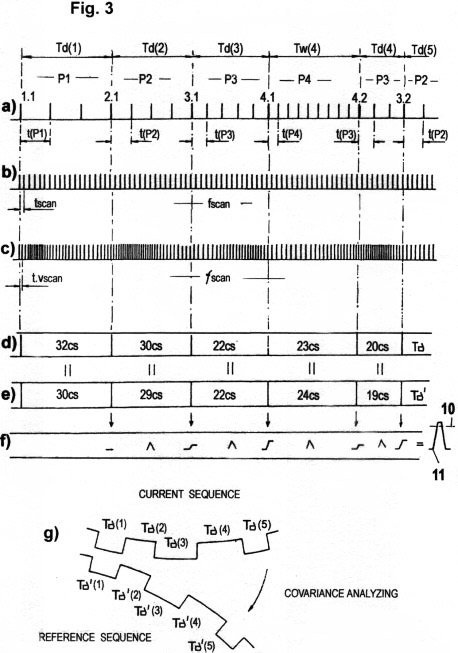
Fig. 3a-c zeigen das in o.g.Patent beschriebene
nichtdeterministische Quantisierungsverfahren im Zusammenhang mit
der seriellen Übertragung erfasster STQ(d)-Verstreichzeiten.
Ausserdem zeigen sie die Zeitimpulsfrequenzmodulation der
gleichzeitig erfassten Parameter der momentanen
Relativgeschwindigkeit (vm).
Fig. 3d-g
zeigen das in o.g. Patent beschriebene
Verfahren zum Vergleichen der aktuell erfassten
STQ-Zeitdatensequenzen mit zuvor aufgezeichneten
STQ-Zeitdatensequenzen, um Isomorphismus bestimmter Zeitstrommuster
zu erkennen. Zum genauen Verständnis bitte die genannte
Patentschrift
US
6174941 studieren!
Alle o.g. Verfahren (Fig. 3a - 3g) spielen bei den Erkennungsprozessen im Gehirn eine essentielle Rolle.
Nun zum eigentlichen "neuronalen Code" im Gehirn:
Figs. 4a - d (s.u.) zeigen ein Modell der Erfassung und Verarbeitung von STQ(d)- und STQ(v)- Verstreichzeiten (s. auch Fig. 3a - g) - sowie zur zeitlichen und motorischen Auto-Adaption - in molekular/biologischem Zusammenhang. Die grundlegenden Elemente des Modells sind in der Neurophysiologie bereits von KATZ, GRAY, KELLY, REDMAN, J. ECCLES u. a. beschrieben worden. Die vorgestellte Erkenntnis ist aber deshalb von besonderer Neuheit, weil hier zum ersten Mal zeitliche und motorische Auto-Adaption auf Basis von STQ-Quanten beschrieben wird. Derartige Systeme bestehen zumeist aus einer Vielzahl von Neuronen (Nervenzellen). Diese Neuronen kommunizieren mit Rezeptoren (sensorischen Neuronen), welche die Erfas- sung und Erkennung der ihrer physikalischen Umgebung ermöglichen. Zusätzlich kooperieren sie auch mit Effektoren (Muskeln etc.) die als ausführende Organe für die motorische Aktivität dienen. Der Ausdruck "Rezeptor" oder "sensorisches Neuron" entspricht dem mechanistischen Begriff "Sensor". Ein "Effektor" ist dasselbe wie ein "Aktuator", wie man ihn aus der Kybernetik-Literatur kennt. Jedes Neuron besteht aus einer Zellmembran, die den Zellkern und den Zellinhalt umschließt. Eine unterschiedliche Anzahl von Fortsätze aus den Neuronen, (Axone, Dendriten) leitet Information zu Effektoren oder anderen Neuronen weiter. Die Verbindungsstelle einer dendritischen oder axionalen Endigung mit einer anderen Zelle wird "Synapse" genannt. Die Neuronen selbst können als komplexe biomolekulare Sensoren und Zeittaktgeber aufgefasst werden; die besagten Synapsen als Zeitdatenanalysatoren, welche die aktuell registrierten Verstreichzeitsequenzen fortgesetzt mit früher registrierten Verstreich-Zeitmustern vergleichen, welche von den sensorischen Neuronen (Rezeptoren) produziert und entlang Nervenfasern zu den Synapsen weitergeleitetet werden. Dort erfolgt eine Art von "Kovarianz-Analyse", und es werden entsprechende Wahrscheinlichkeitsdichte-Signale generiert, die an benachbarte neuronale Systeme oder an Effektoren geleitet werden.
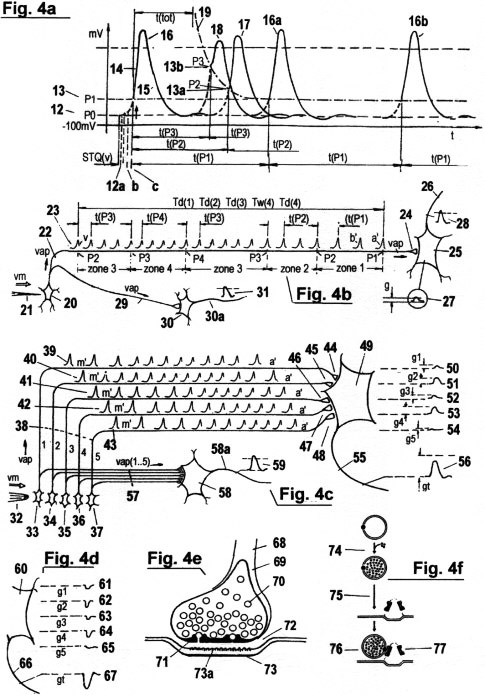
4a zeigt ein sogenanntes "Aktionspotential" AP, das durch
eine abrupte Änderung der Verteilung von Natrium-Ionen und Kalium-
Ionen zwischen dem intrazellulären und extrazellulären Lösungsgemisch
entsteht,
welches wie ein Kondensator arbeitet. Diese Ionen-Konzentrationen
behalten ein bestimmtes Gleichgewicht, solange kein Stimulus an der
Rezeptor-Zelle auftritt.
In diesem Gleichgewichts-Zustand ist ein
konstantes negatives Potential 12 an der Zell-Membran vorhanden,
das "Ruhe-Potential" genannt wird. Sobald ein Rezeptor einen Stimulus aus
einer externen Signalquelle wahrnimmt, fließen Na+ Ionen in die
neuronale Zelle und bewirken, dass sich die Verteilung positiver und
negativer Ionen plötzlich umkehrt, und die Zell-Membrane
"depolarisiert" wird. Je nach Intensivität dieses Rezeptor-Reizes
entstehen nun folgende Effekte:
(a) Wird die Schwelle P1 nicht erreicht, so entsteht ein sogenanntes
"elektrotonisches Potential" EP, das
sich entlang der Zell-Membran (bzw. der axonalen Faser) passiv
fortpflanzt, und in bezug auf
zurückgelegte Zeit und Ort seines Auftretens exponentiell
abnimmt. Die Produzierung eines EP
ist vergleichbar mit dem Anzünden einer leeren Zündschnur.
Das Feuer wird sich ein Stück weit
ausbreiten, dann im weiteren Verlauf schwächer werden
und schließlich verlöschen. EP's entstehen
bei jeder Reizung eines Neurons.
(b) Wird die Schwelle P1
überschritten, so entsteht ein "Aktionspotential" AP (wie in Fig.
4a), das sich entlang der
Zell-Membran (bzw. der axonalen Faser) mit konstanter Amplitude
in selbstregenerierender Weise
fortpflanzt. Die Produzierung eines AP ist vergleichbar mit
dem Auftreten eines Funkens an einer
intakten Zündschnur; das entflammte Zündpulver
erhitzt benachbarte Abschnitte der
Zündschnur soweit, dass dort das Pulver ebenfalls
entflammt usw., wodurch sich die Flamme
entlang der Zündschnur fortpflanzt.
AP's werden zur Quantisierung von STQ(d)- und STQ(v)-Verstreichzeiten verwendet. Sie sind praktisch äquivalent zu jenen Identifikations-Impulsen IP mit den Perioden t(P1), (t(P2), (t(Pn)..., welche in Fig. 3a gezeigt werden. AP's zeigen das Auftreten von Phasen-Übergängen an, von denen STQ(d)-STQ(v)- Verstreichzeiten abgeleitet werden. Zusätzlich bewirken sie indirekt die Aktivierung molekular/biologischer "Zeitmesser" zur Aufnahme solcher Zeiten. AP's stellen jedoch weder deterministische Samplingraten für irgendeine Amplitudenabtastung dar, noch entsprechen sie elektronischen Spannungs/Frequenz-Wandlern. Außerdem ist ihre Amplitude unabhängig von der Reizintensivität am Rezeptor, und sie stellen auch keinerlei Zeittakt-Impulse für die Messung von Verstreichzeiten dar. Hingegen wird die Erfassung solcher STQ-Verstreichzeiten von den Geschwindigkeiten beeinflusst und moduliert, mit denen die Aktionspotentiale sich entlang den Nerven-Fasern (Axonen) und den Membran-Distrikten fortpflanzen. Die zeitmessenden Eigenschaften von AP's werden hier wie folgt detailliert beschrieben: Wenn ein EP - in Antwort zu einem Rezeptor-Reiz - einen bestimmten Schwellwert (P1) 13 überschreitet, dann löst es ein AP 16 aus. Der Amplitudenverlauf eines AP fängt mit dem Aufstrich 14 an und endet mit der Repolarisation 15, beziehungsweise mit der sogenannten "Refraktärphase". Nach dem Ende dieses Vorganges kehrt das Membran-Potential wieder zum Ruhepotential P0 zurück, und die Ionen-Verteilung gelangt wieder ins Gleichgewicht. Nicht jeder Rezeptor-Stimulus erzeugt genügende elektrische Leitfähigkeit, um ein AP zu produzieren. Solange er unter einer Minimalschwelle P1 bleibt, erzeugt er nur das zuvor erwähnte elektrotonische Potential EP. (Für ein besseres Verständnis von Verstreichzeitmessungen in biologisch/chemischen Modellen betrachte man nochmals Fig. 2c und Fig. 3a): Das erste AP, das nach Stimulieren eines Receptors ausgelöst wird, erzeugt zunächst (indirekt) jenen Impuls, der den ersten Zeitmesser zur Aufnahme der ersten STQ(d)- Verstreichzeit aktiviert, wenn die Signalamplitude W das Schwellwert-Potential P1 bei Phasenübergang iTw(1.1) durchbricht. Gleichzeitig stellt es auch einen Identifikations-Impuls IP dar. Das erste AP entspricht quasi dem ersten IP aus einer Reihenfolge von IP 's, die den jeweiligen Status des Schwellenwerts (oder Wahrnehmungbereichs) anzeigen, wo sich die Stimulations- Intensitivität gerade befindet. So lange der Rezeptor-Reiz bestehen bleibt, wiederholt sich ein AP 16a, 16b... in zeitlichen Intervallen, deren Periode von der Höhe des jeweiligen Schwellwertes abhängt, in dem sich der Stimulus gerade befindet. Diese Intervalle entsprechen jenen IP- Perioden t(P1), t(P2)... welche für die serielle Zuordnung und Verarbeitung von STQ- Verstreichzeiten erforderlich sind (s. Fig. 3a). Die AP-Frequenz wird stabilisiert durch die sogenannte "relative Refraktärphase" (Ausfallzeit) nach jedem AP, während derer keine neue Depolarisation möglich ist. Weil sich die Refraktär- Phase in adaptiver Weise proportional zu einer zunehmenden Reiz-Intensität beim Rezeptor verkürzt (z. B. wenn das EP einen höheren Schwellwert P2 bzw. Wahrnehmungs-Bereich 13a erreicht), besteht demnach eine Ähnlichkeit zu einem "programmierbaren bistabilen Multivibrator" wie er in der mechanistischen Elektronik zu finden ist. Der Verlauf dieser Ausfallzeit ("Refraktorität") nach einem AP folgt der strichpunktierten Linie 19.
Weiters zeigt Fig. 4a, daß es nach dem Ende einer Repolarisation eine "absolute Refraktoritäts-Periode" t(tot) gibt. Kein neues AP kann während dieser Zeit ausgelöst werden; egal, wie hoch die Reiz- Intensität am Rezeptor steigt. Auf diese Weise ist das "maximale Ausmaß" einer gerade noch wahrnehmbaren Reizintensität programmiert. Wichtig ist die Tatsache, dass sowohl die Dauer der relativen Refraktärphase als auch die Charakteristik der absoluten Refraktoritätsphase auto-adaptiven Gesetzmäßigkeiten unterworfen sind, und sich daher kontinuierlich an neu auftretende Zustandsveränderungen im Organismus anpassen. Das bedeutet, dass auch jene Schwellwerte P0, P1,...., aus denen STQ-Quanten abgeleitet werden, keine absoluten Größen sind, sondern adaptiven Veränderungen unterliegen, wie alle anderen Parameter, insbes. "Zeit", auch. Nun wird erklärt, was nach der Registrierung einer erster STQ(d)-Verstreichzeit bei P1 durch das erste "AP" weiter geschieht: Steigt die Reizintensität (mit einer theoretischen Amplitude W) von der niedrigeren Schwelle P1 zu einer nächsthöheren Schwelle P2 an, dann verursacht das nächste folgende AP indirekt die Registrierung der zweiten STQ(d)- Verstreichzeit, sobald der Phasenübergang durch die nächsthöhere Schwelle P2 erfolgt. Derselbe Vorgang wiederholt sich in Hinsicht auf die Schwellwerte P3, P4 usw. In jedem Fall fungiert das AP gleichzeitig als Identifikations- Impuls IP, wie zu Fig. 3a beschrieben. Es wiederholt sich deshalb in schwellwertabhängigen Perioden solange, als eine Wahrnehmung auf den Rezeptor einwirkt (bzw. solange der Rezeptor etwas "wahrnimmt"). Als Beispiel sei Fig. 3a betrachtet: Solange die Reizintensität in Zone P2 verweilt, kehrt das AP 17, 17a, 17b... in kurzen zeitlichen Perioden wieder. Diese Perioden (oder Intervalle) entsprechen jenen der IP-Identifikations-Impulse mit der Periode t(P2), welche zur seriellen Registrierung der STQ-Verstreichzeiten Td(2) und Tw(2) erforderlich sind. Erreicht die ansteigende Reizintensität den Schwellwert P3 (bzw. die Wahrnehmungsbereichszone 3) 13b, dann wiederholt sich das AP 18a, 18b, 18c... in noch kürzeren Zeitperioden. Dies entspräche jenen IP-Identifikations-Impulsen mit der Periode t(P3) in Fig. 3a , welche indirekt für das serielle Timing der STQ-Verstreichzeiten Td(3) und Tw(3) erforderlich sind. Eine noch größere Reizintensität, zum Beispiel in P4 (oder in Zone 4), würde eine noch kürzere Periode von AP 's erzeugen. Dies entspräche etwa t(P4) in Fig. 3a. Die maximal mögliche AP-Impuls- Frequenz wird jedoch von t(tot) bestimmt. Kürzere Refraktäritäts-Phasen nach der Depolarisation von APs produzieren auch kleinere AP-Amplituden. Diese Eigenschaft vereinfacht die Zuordnung von AP 's zusätzlich. Im folgenden Teil wird die Generierung der eigentlichen Zeitzählimpulse für die STQ- Quantisierung beschrieben. Diese Zeitzählimpulse sind entweder invariable ITPC oder vm- proportionale VTCP wie sie in Fig. 3a gezeigt wurden. Wie erwähnt, sind die Zeitzählimpulse für das Quantisieren von Verstreichzeiten durch jene Geschwindigkeit bestimmt, mit dem sich ein AP entlang eines Axons fortpflanzt. Diese Geschwindigkeit hängt weiters ab vom Ruhepotential und von der Menge des Na+ Ionen-Stroms in den intrazellulären Raum beim Beginn des Depolarisations-Prozesses, sobald die Wahrnehmung an der Rezeptor-Zelle einen elektrischen Strom verursacht, der das extra/intra-zellulare Ionen-Gleichgewicht beeinflusst. Am Beginn der Stimulation eines Rezeptors (dem Ausgangspunkt der Wahrnehmung), fließt nur kapazitiver Strom vom extra-zellularen Raum zur intra-zellularen Flüssigkeit. Dies ruft das besagte "elektrotonische Potential " EP hervor, der sich passiv fortpflanzt. Erst dann, wenn dieses EP die Schwelle P1 überschreitet, wird ein AP produziert, das sich in selbstgenerierender Weise entlang den Membran-Distrikten fortpflanzt. Je mehr kapazitiver Strom noch nach der Depolarisation (bzw. Umladung) des Membran-Kondensators während der Stimulus-Initialisierung verfügbar ist, desto größer ist die Na+-Strömung in den intra-zellularen Raum, und desto mehr EP-Strom kann in noch nicht depolarisierte Gebiete fließen. Auf diese Weise wird das Tempo weiterer Depolarisations-Prozesse in den Nervenfasern, und somit auch die Fortpflanzungsgeschwindigkeit der weiteren AP's, proportional erhöht. Die Umladungszeit des Membran-Kondensators ist also jener Parameter, der die Größe des Ruhepotentials 12 bestimmt. Startet ein Reiz vom niedrigsten Ruhepotential P0 12 aus, so ist der Na+ Einstrom am größten, der Anstieg des EP ist am steilsten und seine elektrotonische Ausbreitung ist am schnellsten. Wird ein AP ausgelöst, dann ist in diesem Fall auch seine Fortleitungsgeschwindigkeit maximal. Aber wenn ein Rezeptor-Stimulus von einem höheren Potential 12a, 12b oder 12c... startet, dann ist der Na+ Einstrom teilweise in- aktiviert, und es nimmt die Steilheit des EP-Anstiegs sowie die Ausbreitungsgeschwindigkeit des elektrotonischen Flusses ab. Deshalb nimmt auch die Fortpflanzungsgeschwindigkeit eines AP ab. Diese besonderen Eigenschaften werden in molekular/biologischen Modellen benutzt, um entweder invariante Zeitzählimpulse ITCP (mit Perioden tscan) oder variable Zeitzählimpulse VTCP (mit Perioden t.vscan) zu produzieren. In letzterem Fall werden die VTCP's entsprechend der relativen Geschwindigkeit vm (via STQ(v)- Parameter) moduliert, und weisen daher entsprechend kürzere Intervalle auf (siehe dazu Fig. 3b und 3c). Das STQ(v)- Quantum wird von der Abweichung des jeweiligen Start-Potentiales in bezug auf das niedrigste Ruhepotential bestimmt, das als "Referenzwert" dient, und wird durch die Dauer der kapazitiven Ladung einer Zell-Membran gemessen, sobald ein Reiz am Rezeptor auftritt. Diese Ladedauer ist umgekehrt proportional zur Geschwindigkeit des Na+ Einstromes durch die Membran-Kanäle in den intra-zellularen Raum. Eine Zellmembran kann als elektrischer Kondensator betrachtet werden, in dem zwei leitende Medien (die intrazelluläre und die extrazelluläre Lösung) durch eine dünne Isolationsschicht, die Membran, voneinander getrennt sind. Beide Medien bestehen aus verschiedenen Arten von Na/K/Cl- Ionen- verteilungen. Je höher die "Stimulus-Dynamik" (siehe unten) ist, welche zuerst das äußere molekulare Medium beeinflusst - das dem Sensor 2 in Abb. 2a entspricht -, und dann das innere molekulare Medium - das dem Sensor 1 entspricht -, desto schneller ist der Na+Einstrom und desto kürzer ist die Ladedauer (welche die Parameter für die Relativgeschwindigkeit vm bestimmt) und desto höher die AP- Fortpflanzungsgeschwindigkeit v(ap) in den benachbarten Membran-Distrikten. Die Signalverläufe an der äußeren und der inneren Seite (bzw.der Membran) entsprechen quasi den Signalamplituden V und W. Die Geschwindigkeit v(ap) generiert also indirekt die beschriebenen invarianten Zeitzählimpulse ITCP oder die variablen vm-proportionalen Zeitzählimpulse VTCP. Die besagten variablen VTCP-Impulse sind selbst-adaptiv modulierte Zeitimpulse mit Korrelation zur relativ zurückgelegten Distanz. Wie im folgenden Abschnitt erklärt wird, existiert (im Gegensatz zu traditionellem physikalischen Verständnis) keine invariante Zeit - nur "wahrgenommene Zeit" ist tatsächlich existent. Von wesentlicher Wichtigkeit ist auch der Unterschied zwischen "Reiz-Intensität", deren Maß von der AP-Frequenz und somit durch die Refraktär-Phase bestimmt wird, und der "Reiz-Dynamik", deren Maß durch die Ladedauer der kapazitiven Zell-Membran - und deshalb von der Geschwindigkeit des Na+ Zustromes - definiert wird. "Reiz- Dynamik" ist nicht gleichzusetzen mit "Reiz-Intensitätszunahme". Es ist ein Maß für die räumlich/zeitliche Abweichung der relativen Position des Rezeptors in bezug auf die Position der Stimulus-Quelle, und deshalb für die relative Geschwindigkeit vm. " Reiz- Intensität" steht für jene Signalamplituden, aus denen vm-adaptive STQ(d)-Verstreichzeiten Td(1,2,3..) abgeleitet werden, während "Reiz-Dynamik" durch die erfassten STQ(v)- Parametern definiert wird.
Fig. 4b und Fig. 4c zeigen die Analyse von STQ-Verstreichzeiten in einem molekular/ biologischen Modell in leicht verständlicher Weise. Die Ergebnisse der Analyse werden dazu benutzt, um redundanzfreie auto-adaptive Muster-Erkennung sowie autonome Regelungs- und Selbstorganisations-Prozesse zu generieren. Im gezeigten Beispiel sollte ein Organismus in die Lage versetzt werden, bestimmte Arten von Fremdkörper, die auf eine Hautpartie drücken, voneinander zu unterscheiden. Er soll mit einem schnellen Muskel-Reflex antworten, wenn er einen Nadelstich als solchen erkennt. Hingegen sollte er den Reiz ignorieren, wenn es sich um einen stumpfen Gegenstand handelt. Dazu ist eine fortgesetzte vm-adaptive Erfassung von STQ(d)-Verstreichzeiten mittels VTCP-Impulse notwendig. Die Frequenz dieser Zeitzählimpulse wird entsprechend den STQ(v)- Parametern aus der Reiz-Dynamik (vm) moduliert. Diese STQ(v)- Parameter werden zur Registrierung der STQ(d)-Verstreichzeiten Td(1,2,3...) aus der Signal-Amplitude der gegenwärtigen Reiz-Intensität benötigt. Der Unterschied zwischen "Reizintensität" und "Reizdynamik" ist in diesem Beispiel leicht zu verstehen. Ein Stimulus kann verschiedene Intensität auch dann aufweisen, wenn keine zeitlich/räumliche Änderung zwischen Signalquelle und Rezeptor stattfindet. Eine Nadel in der Haut kann auch bei unveränderter Position ein unterschiedliches Empfindungsmuster bewirken, beispielsweise wenn sie erwärmt wird. Dieses Empfindungsmuster wird von der Signalamplitude und somit von der AP-Frequenz und den STQ(d)-Quanten bestimmt. Befindet sich die Nadel in einer invarianten Position, so ist die AP-Fortleitungsgeschwindigkeit konstant, da auch die Membranladezeit konstant ist. Während des Stiches in die Haut ereignet sich ein "dynamischer Reiz", und die STQ(d)-Quantisierung der Signalamplitude geschieht in Abhängigkeit vom Verlauf der Einstichgeschwindigkeit vm. Man beachte, daß während dieses dynamischen Prozesses immer 2 zeitlich verschobene Signal-Amplituden (an der äußeren und der inneren Membranseite) existieren. Die beschriebenen STQ(v)-Parameter leiten von ihnen her. Dem- entsprechend werden die Geschwindigkeiten der AP- Fortpflanzung und die erworbenen STQ(d)- Zeitmuster angepasst ("zeitliche Auto- Adaption"). Diese entsprechend zu vm adaptiv gemessenen STQ(d)-Zeitmuster Td(1,2,3...) werden ständig mit vorausgehend gemessenen und gespeicherten STQ(d)- Zeitmustern Td'(1,2,3...) verglichen und zusammen ausgewertet. Dieser Zeitvergleichs-Prozess geschieht fortgesetzt in den sogenannten "Synapsen", welche die Verbindungsstellen zu axionalen Endigungen anderer Neuronen bilden. Die Wahrscheinlichkeitdichte-Werte, die in den Synapsen ermittelt werden, und die für eine Konvergenz beider Regressions-Kurven stehen, werden zur weiteren Verarbeitung zu peripheren neuronalen Systemen, oder auch an Muskelfasern weitergeleitet, um motorischen Reflex hervorzurufen.
Fig. 4b zeigt die vm- abhängige
Fortpflanzung eines AP von einem Sensor-Neuron (Rezeptor)
20 entlang eines Neuronenfortsatzes (Axon) zu einer Synapse,
wo ein Vergleich mit erworbenen Zeit-Sequenzen mittels molekularer
"Kovarianzanalyse" stattfindet. Dieser Rezeptor funktioniert wie
ein "Druck-Sensor". Wenn eine Nadel 21 mit einer bestimmten Dynamik
auf die äußere Schicht der Zell-Membran trifft, dann verursacht
diese Stimulation das Auslösen von AP's 23, wie in Abb. 4a
beschrieben. Die AP's pflanzen sich im Axon 22 mit einer STQ(v)-
abhängigen Geschwindigkeit vap fort. Ihre Reihenfolge (a'....v ')
entspricht jenem Signal- amplitudenverlauf, der vom Stich
hervorgebracht wird. Die Reihenfolge fängt mit dem Phasendurchgang beim ersten Schwellwert P1 an, geht weiter über P2, P3, P4
(an deren Stelle das Reizmaximum erreicht wird), und kommt
schließlich zu den Phasendurchgängen P3 und P2. Die
Intensitätsbereiche der Reizwahrnehmung sind mit Z1, Z2, Z3 und Z4
bezeichnet. Die Perioden t(P1), t(P2), t(P3), t(P4).... und die
Magnituden der AP's dienen zur Identifikation der jeweiligen
Schwelle, wo die Reizintensität sich gegenwärtig befindet. Ihre
zeitliche Reihenfolge ist deshalb eine Art von "Code". AP's sind
keine Zeitzählimpulse. Neben ihrer Code- Funktion sind sie aber auch
(indirekt) Startimpulse und Stopimpulse für die Registrierung von
STQ(d)- Verstreichzeiten. Die eigentliche vm-abhängige Messung der
STQ-Verstreichzeiten Td(1), Td(2), Td(3), Tw(4) und Td(4)..(s. Abb.
2c), sowie ihr Vergleich mit vorausgehend erfassten
Verstreichzeiten findet in der Synapse 24 statt.
Am
präsynaptischen Ende des Axons laufen die AP 's 23 mit variablen
Geschwindigkeiten vm(n ...) ein, die in Relation zur Dynamik des
Nadel-Stiches sowie zu den gemessenen STQ(v)- Parametern stehen.
Diese variablen Einstrom-Geschwindigkeiten an den Synapsen sind der
Schlüssel zum Produzieren jener adaptiven Zeitzählimpulse VTCP
(s.Fig. 3c) mit der vm- modulierten Frequenz ƒscan. Die Synapse ist
durch den "synaptischen Spalt" von der postsynaptischen Membran
getrennt; diese wiederum ist mit anderen Neuronen verbunden, z. B.
mit einem sogenannten "Motoneuron" 25. Ein solches Neuron
produziert ein sogenanntes "exzitatorisches postsynaptisches
Potential" (ESPS) 27, das etwa proportional zur Wahrscheinlichkeit
g einer Konvergenz ist. Wenn dieses EPSP (bzw. die
Wahrscheinlichkeitsdichte g) einen bestimmten Schwellwert
übersteigt, dann wird erneut ein Aktionspotential AP 28
ausgelöst.Dieses AP wird über Motoaxon 26 zu einer sogenannten
"neuromuskulären Endplatte" weitergeleitet, die dort den
Muskelreflex verursacht. Die einlaufenden AP- Sequenzen 23 bewirken
die Freisetzung bestimmter Quanten von molekularem Transmitter-
stoff aus ihren Depots - winzigen kugelförmigen Strukturen in der
Synapse, "Vesikel" genannt. Im Prinzip stellt eine Synapse einen
komplexen programmierbaren Zeitdatenprozessor und -Analysator dar,
der immer dann den Inhalt jeweils eines Vesikels in den
präsynaptischen Spalt entleert, wenn das Wiederauftreten
irgendeiner früher registrierten synaptischen Struktur innerhalb
einer neu registrierten Schlüssel-Struktur bestätigt wird. Die
synaptischen Struktur innerhalb einer neu registrierten
Schlüssel-Struktur Strukturen und Vesikel- Bewegungen werden von der
Dynamik v(ap) des AP-Ioneneinstroms sowie seiner Frequenz erzeugt.
AP-Einstromgeschwindigkeiten v(ap) entsprechen den STQ(v)-
Parametern, die AP-Frequenzen den STQ(d)-Verstreichzeiten. Die
Transmitter-Substanz wird durch die Synapse reabsorbiert und
wiederverwertet, sodaß der Zyklus nicht unterbrochen wird. Hier
eine ausführliche Beschreibung von Fig. 4b unter Bezugnahme auf Fig.
4e und Fig. 4f: Der Ionen-Einstrom vom ersten einlaufenden AP
23
(a') aktiviert zunächst die Ansammlung von ACh-Transmittermolekülen
in den kugelförmigen Strukturen (Vesikeln). Die Dauer dieser
ACh-Ansammlung hängt ab von der Dynamik (= Geschwindigkeit vap) des
AP-Ionen- Einstromes an der präsynaptischen Endigung und somit auch
der Reiz-Dynamik (= vm) am Rezeptor 20. Die Freisetzung der
Moleküle in den synaptischen Spalt erfolgt in Form von "Paketen".
Jedes nacheinander einlaufende AP - bezeichnet mit b', c'..-
bewirkt eine erneute Ansammlung von Neurotransmitterstoffen in
Vesikeln, die sich nach erfolgter Auffüllung in Richtung des
synaptischen Spalts bewegen. Alles Folgende hat
Verstreichzeit-messende und -analysierende Eigenschaften: Die Dauer
der Auffüllung mit Transmittersubstanz T(t), die Geschwindigkeiten
v(t), mit dem sich die Vesikel in Richtung des synaptischen Spalts
weiterbewegen, ihre Einwirkung auf das synaptische Gitter am Spalt
und ihre Positionen, die Öffnungsdauer der Poren usw. Durch diese
AP-Einwirkung auf die synaptischen Strukturen werden nicht nur die
eigentlichen Zeitzählfrequenzen ƒscan generiert (zur vm-abhängigen
Messung jener in Abb. 2c beschriebenen STQ(d)-Versteichzeiten),
sondern es werden auch Zeitmuster gespeichert und analysiert. Wenn
von der Synapse das Muster eines aktuellen zeitlichen Ablaufes
erkannt wird, das mit einer bestehenden gespeicherten Struktur
übereinstimmt, dann öffnet sich eine Pore beim synaptischen
Gitter, und der ganze molekulare Inhalt eines Vesikels wird in die
subsynaptischen Spalt freigesetzt. Die freigesetzten Transmitter-
Moleküle (zumeist ACh) binden sich an der anderen Seite des Spalts
an spezifische Rezeptormoleküle auf der subsynaptischen Membran des
angekoppelten Neurons. Dadurch wird dort ein postsynaptisches
Potential (EPSP) hervorgerufen, das sich dann an andere Synapsen,
Dendriten oder an eine sogenannte "neuromuskuläre Endplatte"
fortpflanzt. Überschreitet das EPSP eine bestimmte Amplitude, dann
löst es ein Aktionspotential (AP) der bereits beschriebenen Art
aus, das dann z.B. einen Muskel-Reflex hervorruft. Erreicht es
diesen Schwellwert nicht, so wird es ähnlich weitergeleitet wie ein
EP (also in elektrotonischer Weise); ein AP wird in diesem Fall
nicht produziert. Von besonderer Bedeutung ist die addierende
Eigenschaft der subsynaptischen Membran. Diese Eigenschaft - auch
als "zeitliche Bahnung" bezeichnet - resultiert aus der Summierung
der erzeugten EPSP's, wenn diese in kurzer Folge innerhalb
bestimmter Zeitfenster eintreffen. Jede Freisetzung von
Transmittermoleküle in den synaptischen Spalt zeigt das Auftreten
einer erhöhten Wahrscheinlichkeits-Dichte während des Vergleiches
aktueller vm-proportional erfaßter STQ-Verstreichzeitmuster mit
früheren vm-proportional erfaßten und gespeicherten Zeitmustern an.
Erhöhte Wahrscheinlichkeits-Dichte verursacht eine höhere
Häufigkeit von Transmittersubstanz- Freisetzung und demnach höhere
Summenwerte von EPSP's, was wiederum als Folge eine signifikant
höhere Rate von postsynaptischen Aktionspotentialen (AP) produziert.
Demnach ist ein postsynaptische AP ein Bestätigungssignal, das
anzeigt, dass Isomorphismus zwischen einem früheren und einem
aktuell registrierten Zeitdatenmuster erkannt worden ist. Auf der
Basis dieses Zeitmuster-Vergleiches wird somit jener Gegenstand,
der die Wahrnehmung bei der Rezeptor-Zelle verursacht hatte, als
"Nadel" identifiziert; und der Befehl: "Muskelreflex auslösen" wird
an die korrespondierenden Muskelfasern weitergeleitet.
Parallele komplexere Erkennungsprozesse laufen über das zentrale
Nervensystem ZNS (dem Gehirn) ab. Vom beschriebenen
druckempfindlichen Hautrezeptor-Neuron 20 gelangt eine weitere
axonale Verzweigung 29 über eine Synapse 30 zu einem "ZNS-Neuron".
Im Unterschied zum "Motoneuron", das direkt die motorische
Aktivität des Organismus steuert, dient ein ZNS-Neuron der
bewussten Erkennung eines rezeptorischen Reizverlaufes. Ein AP
31,
das an der postsynaptischen Zellmembran 30 produziert wird, kann
auch entlang Dendriten in ein Axon 30a münden, und sich zu mehreren
anderen ZNS-Neuronen verzweigen; es kann aber auch indirekt über
ZNS-Neuronen zu einem Motoneuron und dann zu einer "neuromusculären
Endplatte" gelangen.
Die Parameter, welche die
Registrierung von STQ-Zeitquanten in den Synapsen 25 und
30
kontrollieren, können sich durch die Verschiedenheit der
synaptischen Strukturen unterscheiden. (Tatsächlich werden ja
diese Strukturen von fortgesetzten "Lern"-Prozessen erzeugt). Dies
erklärt, warum es möglich ist, dass ein Nadelstich zwar im Gehirn
als solcher registriert wird, aber keinen Muskel-Reflex
hervorruft; oder aber ein schneller Muskel-Reflex entstehen kann,
dessen Ursache durch das Gehirn kaum wahrgenommen wird. Der eine
Fall zeigt einen bewussten Reflex, der andere Fall einen
instinktiver Reflex. Letzterer tritt auf, wenn die ZNS-Synapse
30
nicht genügend isomorphe Strukturen findet (im Gegensatz zur
Synapse 25), daher keine ausreichend häufige Freisetzung von
Transmittermolekülen erfolgt, und infolgedessen auch kein
postsynaptisches AP 31 und keine bewusste Erkennung des
wahrgenommenen Reizes stattfinden kann.Viele Funktionen des
zentralen Nervensystemes können so auf monistischer Grundlage
erklärt werden; sogar Phänomene wie "Bewusstsein" und
"Unterbewusstsein". Im allgemeinen sind auto-adaptive Prozesse in
Organismen vielseitig vernetzt und deshalb äußerst komplex. Um
fähig zu sein, auf der Haut einen Nadelstich vom Drücken mit einem
stumpfen Radierstift zu unterscheiden, sind wesentlich mehr
Zeitmuster notwendig; auch müssen mehr Rezeptoren und Synapsen in
den Erkennungsprozess einbezogen werden.
Fig. 4c zeigt
einen Prozess, bei dem das leichte Drücken mit einem stumpfen
Gegenstand (z.B. einem konischen Radiergummi auf einem Stift)
erkannt wird - wo aber daraus kein Muskelreflex resultiert. Der
stumpfe Gegenstand 32 presst mit einer bestimmten relativen
Geschwindigkeit vm auf eine Reihe von Rezeptoren in den neuronalen
Hautzellen 33, 34, 35,
36 und 37. Aus der Stimulierung der
einzelnen benachbarten Rezeptoren (s. auch Fig. 4b) resultieren
verschiedene Sequenzen von AP's 39, 40,
41, 42 und 43. Diese
Aktionspotentiale pflanzen sich entlang den kollateralen Axonen
38
mit variablen Perioden t(P1,2,3.....) und Geschwindigkeiten
vap(1...5) fort, die einerseits von der gegenwärtigen
Reizintensität, anderseits von der jeweiligen Reizdynamik abhängig
sind. Da jeder Rezeptor-Reiz ein anderes Muster aus STQ(v) und
STQ(d)- Quanten erzeugt, ergeben sich für jedes Axon verschiedene
AP-Sequenzen a'....m'. Alle einzelnen Sequenzen zusammen stellen
jenes Muster aus STQ- Verstreichzeiten dar, das für den Druck mit
dem Radierer auf der Haut charakteristisch ist. Diese variablen
AP-Ionenströme gelangen zu den Synapsen 44, 45,
46, 47 und 48,
welche über den synaptischen Spalt mit dem Motoneuron 49 verbunden
sind. Sobald das aktuell erfasste Zeitdatenmuster eine Ähnlichkeit
zu einem früher erfassten Zeitdatenmuster aufweist, setzt jede
einzelne Synapse den Inhalt eines Vesikels in den subsynaptischen
Spalt frei. Gleichzeitig produziert diese Freisetzung ein ESPS an
der subsynaptischen Membran des Neurons. Diese Potentiale sind
zumeist unterschwellig. Der nötige Schwellwert für die Auslösung
eines AP wird nur dann erreicht, wenn mehrere EPSP's summiert
werden. Dies geschieht nur dann, wenn eine sogenannte "zeitliche
Bahnung" solcher Potentiale stattfindet, wie im Abschnitt zuvor
beschriebenen wurde.
Im gezeigten Modell wirken sich diese
addierenden Eigenschaften auf die einzelnen ESPS's 50,
51, 52, 53
und 54 aus. Diese Potentiale entsprechen den rezeptor-spezifischen
Wahrscheinlichkeitsdichte-Parametern g1, g2. g3, g4 und g5, die für
den jeweilige Grad an Isomorphität von Zeitmustern stehen.
Gleichzeitige Transmitterfreisetzung in mehreren Synapsen (z.B. in
45 und 47) bewirkt die Addierung der einzelnen EPSP's zu einem
Gesamt- Potential 56, das der Summe der einzelnen
Wahrscheinlichkeitsdichten (G) = (g1+ g3) entspricht. Diese
Eigenschaft der Neuronen, räumlich getrennte unterschwellige EPSP 's
zu summieren, wenn gleichzeitige Transmitter-Freisetzung bei einer
Anzahl paralleler Synapsen auf der selben subsynaptischen Membran
auftritt, bezeichnet man als "räumliche Bahnung". Im beschriebenen
Modellfall erreicht das summierte EPSP 56 aber nicht die bezeichnete
Schwelle (gt) und es wird daher kein AP ausgelöst. Statt dessen
pflanzt es sich im subsynaptischen Membrandistrikt 49 des Neurons
bzw. im nachfolgenden Motoaxon 55 als passives elektrotonisches
Potential (EP) fort. Ein solches EP schwächt sich (zum Unterschied
von einem selbst-regenerierenden aktiven AP) nach wenigen
Millimetern im Axon soweit ab, dass es keinerlei aktivierenden
Einfluss auf die neuromuskuläre Endplatte hat, und somit auch
keinen aktivierenden Einfluss auf den Muskel. Die Reizung der Haut
und das Anpressen mit dem Radierstift reicht also nicht aus, um
einen Muskelreflex hervorzurufen. Anders wäre es der Fall, würde
der Radiergummi abbrechen und der leere Stift mit voller Wucht auf
die Haut- Rezeptoren treffen. In diesem Fall würde eine
Transmitterfreisetzung gleichzeitig in allen fünf Synapsen 50,
51,
52, 53 und 54 ausgelöst, weil die erfassten STQ-Zeitmuster
Td(1,2,3....) mit sehr hoher Wahrscheinlichkeit ähnlich mit jenen
in den synaptischen Strukturen gespeicherten STQ-Zeitmustern
Td'(1,2,3..) wären, die für das Ereignis "Nadelstich" signifikant
sind. Die EPSP 's würden wegen der Eigenschaft ihrer zeitlichen und
räumlichen "Bahnung" zu einem überschwelligen EPSP 56 addiert
werden und ein postsynaptisches AP
hervorrufen, das sich im Motoaxon 55 in einer
selbstregenerierenden Weise (ohne zeitliche und räumliche
Abschwächung) bis zum Muskel fortpflanzen würde um einen
Muskel-Reflex zu produzieren. Wie in Fig. 4b, so kommt es auch im
vorliegenden Beispiel zu einem parallel verlaufenden
Erkennungsprozess, der im zentralen Nervensystem (ZNS) stattfindet.
Von den Hautrezeptor-Zellen 33, 34,
35, 36 und 37 gelangen
kollaterale axonale Verzweigungen 57 zu ZNS- Synapsen, die an andere
Neuronen 58 gekoppelt sind. Solche Verzweigungen werden als
"Divergenzen" bezeichnet. Die Aufsplitterung der Axone in
kollaterale Verzweigungen zu verschiedenen neuronalen
ZNS-Distrikten, und die zeitliche und räumliche Kombination vieler
postsynaptischer EPSP's ermöglicht die bewusste Erkennung komplexer
Wahrnehmungen im Gehirn (z.B. die Tatsache, dass ein Radierstift
auf die Haut drückt). Da diese Erkennung unabhängig von der
Auslösung eines etwaigen Muskelreflexes stattzufinden hat, muss die
Summe einzelner ESPS's im ZNS auf jeden Fall überschwellig sein.
Ansonsten könnte kein postsynaptisches AP - und somit auch kein
Bestätigungssignal produziert werden.
Als wesentliche
Vorbedingung dazu ist notwendig, daß auto-adaptive Prozesse
vorangingen, wodurch bestimmte präsynaptische und subsynaptische
STQ-Zeitstrukturen in den parallelen Synapsen 58 geprägt wurden.
Diese Strukturen enthalten Information (Zeitsequenzen,
Zeitmuster..), die für ähnliche Sinnes-Erfahrungen stehen (z. B. in
die Haut eindringende Gegenstände, darunter auch der besagte
Radierstift). Offensichtlich hat die Schwelle für das Verursachen
eines AP's in der postsynaptischen Membran-Struktur der ZNS-Neuronen
58, (und deshalb auch im Gehirn) niedriger zu sein als beim vorher
beschriebenen Motoneuron 49. Daher muss auch die Summe dieser
ESPS's größer sein als diejenige der ESPS's g1, g2, g3, g4 und g5.
Isomorphitäten von STQ-Zeitdatenreihen in den ZNS-Synapsen des
Gehirns haben demnach ausgeprägter zu sein als jene in den Synapsen
von Motoneuronen, die nur für Muskelreflexe zuständig sind. Die
Strukturen von ZNS-Synapsen müssen Informationen besser
unterscheiden können, und somit subtiler beschaffen sein. Das
Auftreten eines sub-synaptischen AP stellt eine Bestätigung für die
Tatsache dar, dass ein aktuell erfasstes Td(1,2,3...)- Zeitmuster
in virtueller Weise isomorph ist mit einem früher registrierten
Td'(1,2,3...)- Referenzzeitmuster, das z.B. aus einer älteren
Sinneserfahrung mit einem an irgendeine Hautstelle drückenden
Radierstift stammt. Hat eine solche frühere Erfahrung nicht
stattgefunden, so hat das Bewusstsein keine physikalische Grundlage
zur Erkennung, da die Zeitmuster-Vergleichsbasis fehlt. In einem
solchen Fall hätte also zunächst ein Lernprozess vorauszugehen.
Meistens werden dazu auch andere, aus verschiedenen Rezeptorreiz-
Ereignissen hergeleitete Empfindungserfahrungen visueller oder
akustischer Art usw. mit der erwähnten Druckempfindungs-Erfahrung
koordiniert.
Dies erklärt, warum ZNS-Strukturen äußerst
umfangreich vernetzt sind. ZNS-Neurone, aber auch Motoneurone,
besitzen bis zu 5000 angekoppelte Synapsen, die in verschiedenster
Weise mit Rezeptor- Neuronen und axonalen Verzeigungen verknüpft
sind. Es existieren komplexe Zeitdaten-Muster für niedrigere und
höhere Aufgabengebiete, die in hierarchischer Weise strukturiert
sind. Einfache Td(1,2,3...) und Td'(1,2,3...)- Analyse-Operationen
wurden bereits beschrieben. Kreislauf, Atmung, Koordination von
Muskelsystemen, Wachstum, Sehen, Hören, Sprechen, Riechen usw.
erfordern eine enorme Anzahl synaptisch registrierter "Landschaften"
von STQ-Zeitmustern im Organismus, die von vielen
Rezeptoren produziert wurden; und welche fortgesetzt auf
Isomorphität mit aktuell aufgenommenen STQ-Zeitmustern analysiert
werden müssen. Dementsprechend ereignet sich zeitliche und
motorische Auto-Adaption in tieferen und höheren Hierarchien und auf
verschiedenen Niveaus.
Fig. 4d zeigt das Gegenstück
zu einem EPSP (erregendes postsynaptisches Potential); das
"inhibitorische postsynaptische Potential", oder IPSP. Wie aus der
Zeichnung zu sehen ist, sind die IPSP- Potentiale 61,
62, 63, 64
und 65 an der subsynaptischen Membran 60 im Unterschied zu besagten
EPSP's negativ. IPSP's werden von einem erheblichen Teil der
Synapsen produziert, um präsynaptische Hemmung statt Aktivierung
hervorzurufen. Das Beispiel zeigt hier ein sich vom Motoaxon
66 zu
einer neuomuskulären Endplatte (beziehungsweise Muskelfaser)
fortpflanzendes Summen-IPSP 67, welches verhindert, dass dieser
Muskel aktiviert werden kann - selbst dann nicht, wenn ein
überschwelliges EPSP zur gleichen Zeit über ein paralleles Motoaxon
die gleiche Muskelfaser erreichen würde.
Positive
EPSP's-Ionenströme und negative IPSP's-Ionenströme heben sich
gegenseitig auf. Die hauptsächliche Funktion von IPSP's besteht
darin, koordinierte und homogene Zustands- veränderungen im
Organismus, z.B. exaktes Timing von Bewegungsvorgängen zu
ermöglichen. Um beispielsweise einen gleichmäßigen Armschwung
durchzuführen, ist es erforderlich, den Musculus biceps, der den
Ellenbogen beugt, mittels EPSP's zu aktivieren; gleichzeitig aber
den antagonistischen Musculus triceps (der den Ellenbogen streckt),
mittels IPSP's zu hemmen. Antagonistische Muskel müssen über
sogenannte "antagonistische Motoneuronen" gehemmt werden, während
der andere Muskel über "homonyme Motoneuronen" aktiviert wird. Der
komplexe Synergismus von erregenden EPSP-Synapsen und hemmenden
IPSP-Synapsen wirkt wie ein Feedback-System (Regelkreis) und
ermöglicht optimales Timing und Effizienz im Organismus. Man kann
diesen Prozess mit einem Servo-Antrieb oder einer Servo- Lenkung
vergleichen, welche eine korrekte koordinierte Ausführung
momentaner Bewegungsphasen durch datenunterstützte Operation und
Regelung ermöglicht. Wenn Daten ausfallen, bricht der Servo-Kreis
zusammen. Störungen in einem molekular-biologischen Regelkreis, der
durch STQ-Zeitdatenstrukturen gestützt wird, führen zu tetanischen
Zuckungen, willkürlichen Kontraktionen, chaotischen Krämpfen
usw.
Vom kybernetischen Standpunkt betrachtet, erzeugt jede
erregende Synapse einen "motorischen Impuls" (EPSP), jede hemmende
Synapse einen "Bremsimpuls" (IPSP). Das stetige Abstimmen der
komplizierten Regelkreise, und die Balance, die aus dem
fortgesetzten Vergleich von früheren sensorischen Erfahrungen (den
gespeicherten referenten Zeitmustern) mit aktuellen sensorischen
Erfahrungen (den aktuell erfaßten Zeitdatenmustern) resultiert,
erzeugt ein "perfektes Timing" im Organismus.
Fig. 4e
zeigt die prinzipielle Gestaltung einer Synapse. Das Axon 68 mündet
in die präsynaptische Endigung 69, die auch "Bouton" genannt wird.
Die seriell einlaufenden AP's verursachen die Auffüllung der
Vesikel mit Neurotransmitter-Mulekülen. Ist der Auffüllprozess
beendet, beginnen sich die Vesikel in Richtung präsynaptisches
Vesikelgitter 71 zu bewegen. Wenn ein gegenwärtig erworbenes
Zeitmuster annähernd isomorph einem bestehenden Zeitmuster ist, (s.
auch Fig. 4b), dann öffnet sich bei einer Andockstelle am
synaptischen Gitter ein kleiner Kanal, der den ganzen Inhalt des
Vesikels in den schmalen synaptischen Spalt 72 freisetzt. Dieser
Vorgang wird auch als "Exozytose" bezeichnet. An der subsynaptischen
neuronalen Membran 73 befinden sich spezifische molekulare
Rezeptoren 73a, an die sich die freigesetzten Transmittermoleküle
heften. Für eine bestimmte Dauer wird eine eine Pore geöffnet,
durch welche die Transmitter-Substanz diffundiert. Die Leitfähigkeit
der postsynaptischen Membran erhöht sich und das besagte EPSP (die
darauffolgende postsynaptische Depolarisation) wird ausgelöst. Die
Öffnungs-Dauer der Poren und die Erkennung komplementärer
Rezeptoren durch die Moleküle wird gleichfalls von auto-adaptiven
Prozessen und Evaluationen von STQ-Zeitmusterstrukturen bestimmt.
Allerdings stellen diese Prozesse Subphänomene von niedrigerer
Stufe im Vergleich zu synaptischen Phänomenen dar.Strukturen
zur zeitlichen und motorischen Auto-Adaption, die auf der
Quantisierung von STQ-Verstreichzeiten beruhen, existieren auch auf
molekularem und atomarem Niveau.
Fig. 4f zeigt das Auffüllen eines
Vesikels 70 mit Transmitterstoffen und seine darauf folgende
Bewegung zu einem präsynaptischen Andockvorsprung am Vesikelgitter
71. Der Beginn der Auffüllung 74 ist mit der Aktivierung einer
Stoppuhr vergleichbar. Das Tempo v(t) der Vesikel- Auffüllung ist
proportional zur Dynamik des AP-Ioneneinstroms vap in die Synapse.
Die Perioden der Auffüllungen T(t...) richten sich nach den
Perioden t(P1,P2...) der eintreffenden AP's; somit stellen diese
Zeiten quasi vm-adaptiv quantisierte STQ(d)- Verstreichzeiten
Td(1,2,3...) usw. dar. Die Vesikel- Bewegungsrichtung ist mit
75
bezeichnet. Wenn das aktuelle Tempo v(t), die Dauer der
Vesikel-Auffüllung T(t), die Transmitter-Menge, die aktuelle
Vesikel-Bewegung und andere aktuelle signifikante STQ-Parameter
korrelative Eigenschaften zu bestehenden synaptischen STQ-Strukturen
haben, so heftet sich ein aufgefüll- tes Vesikel an einen
Andockvorsprung 77 am Gitter. Ca++ Ionen strömen in die Synapse ein,
eine Pore am kristallinen Vesikelgitter öffnet sich, und der
gesamte molekulare Transmitterinhalt entleert sich in den
synaptischen Spalt 72. An der postsynaptischen Membran der
Zielzelle fusionieren sich diese Moleküle mit den spezifischen
Rezeptor-Molekülen. Diese Rezeptoren haben
Verifizierungs-Aufgaben. Sie verhindern, dass fremde
Transmitterstoffe (die aus anderen Synapsen stammen) an diesem
Neuron falsche ESPS's auslösen könnten. Zur Vervollständigung
dieses Kapitels werden die Beschreibungen zu Fig. 4a, 4b, 4e
und 4f in Kontext zu den STQ-Konfigurationen von Fig. 3c - 3g gebracht.
Als Argumentationsbeispiel wird wieder angenommen, dass ein Nadelstich auf eine
Rezeptor-Zelle trifft (s. auch Fig. 4b): Jene IP-Sequenzen, die in
Fig. 3a gezeigt werden, entsprechen den AP's 23, die durch das
Stimulieren einer Rezeptorzelle 20 mit einer Nadel
21 produziert
werden. Ihre Perioden t(P1), t(P2) ... dienen der Zuordnung der
jeweiligen Zone der Reizintensität (P1, P2...) oder der
Wahrnehmungsintensität (Z1, Z2..). Jedes in einer Synapse 69
einlaufende AP löst eine von seiner axonalen
Fortleitungsgeschwindigkeit (vap)-abhängige adaptive Quantisierung
von STQ(d)-Verstreichzeiten aus. Die Verstreichzeitnahme mit
modulierter Zeitbasis wird ausgelöst, sobald eine
Vesikel-Auffüllung beginnt. Eine beendete Auffüllung bedeutet
"Verstreichzeitnahme gestoppt; STQ(d)-Quantum registriert". Diese
solcherweise registrierten Verstreichzeiten Td(1), Td(2), Td(3),
Td(4)...usw. generieren die signifikanten synaptischen Strukturen.
Invariante Zeitzählimpulse ITCP (s. Fig. 3b) mit der Frequenz fscan
entsprechen einer konstanten axonalen AP-Fortpflanzung mit der
Geschwindigkeit vap, wenn kein dynamischer Stimulus der besagten
Hautrezeptor-Zelle gegeben ist; (z.B. wenn eine Nadel in einer
fixen Position verharrt und eine konstante Reizintensität erzeugt).
In diesem Fall erfühlt die Rezeptor-Membran keine relative
Geschwindigkeit vm, die AP 's pflanzen sich mit fixem vap entlang
dem Axon 22 fort; und die Synapse quantisiert die
STQ(d)-Verstreichzeiten mit invarianter Zeitzählfrequenz
fscan.
Jene Zeitzählimpulse VTCP (s. Fig. 3c) mit der
variablen Frequenz ƒscan kommen dann zur Anwendung, wenn ein
dynamischer Reizverlauf auf den Rezeptor einwirkt. Moduliert nach
der jeweiligen variablen Dynamik vm(n...), welche als
STQ(v)-Parameter von der Membran gemessen wird, pflanzen sich die
AP's entlang des Axons mit STQ(v)-proportionaler Geschwindigkeit
vap(n..) fort. In gleicher Weise, wie in der Beschreibung zu Fig. 3c
die adaptive Anpassung der Zeitzählfrequenzen zu den Übergängen
2.1, 3.1, 4.1... dargelegt wurde, so ändern sich hier die
AP-Ioneneinstrom-Geschwindigkeiten v(t....) an der Synapse, die
Vesikel-Auffüllzeiten T(t...), die Quantität der Transmittermoleküle
in Vesikeln, ihre Bewegung in Richtung Vesikel-Gitter, die Struktur
dieses Gitters und viele andere Parameter der präsynaptischen und
subsynaptischen Strukturen.
Eine Synapse besitzt
Eigenschaften, die es ermöglichen, die Dynamik der einströmenden
AP's in vap-proportionale molekulare Zustandsveränderungen
umzusetzen. Diese wirken so, wie variable VTCP-Zeitzählimpulse in
Fig. 3c. Der Prozess kann verglichen werden mit variablem
Wasserdruck, der eine Turbine antreibt, durch welche ein Generator
variable Frequenzen erzeugt, die vom Druck und vom Tempo des
Wassers abhängen: erhöhter Wasserdruck steht für höhere Reizdynamik
am Rezeptor, für höhere axonale AP-Fortleitungsgeschwindigkeit vap,
und für höhere VTCP-Zeitzählfrequenz ƒscan in der Synapse (die sich
nicht nur auf das Tempo v(t) auswirkt, mit dem Vesikel sich
auffüllen, sondern auch auf viele andere synaptische Parameter).
Entsprechend dieser Prozesse werden die STQ(d)-Sequenzen
Td(1,2,3...) usw. in der Synapse mit vm-modulierten
Zeittaktfrequenzen ƒscan (1,2,3...) registriert; und als Konsequenz
daraus wird von dieser Zeitreihe die physikalische Struktur der
Synapse geprägt. Fig. 3d zeigt eine aktuell erfasste Zeitdaten-Reihe
32 30 22 23 20, die äquivalent ist zum registrierten Zeitmuster
Td(1,2,3,...), welche in der Synapse 24 eine spezifische moleku-
lar/biologische Spur hinterlässt. Die gezeigte früher erfasste
Zeitdatenreihe 30 29 22 24 19 in Fig. 3e entspricht jener
synaptischen Struktur, die durch oftmalige Reproduzierung bestimmter
Stimulus-Ereignisse und Zeitmuster Td'(1,2,3...) "geprägt" worden
ist.
Die manifestierte synaptische Td'- Struktur kann auch
als Fußstapfen-Sequenz betrachtet werden, die durch fortgesetzte
Lern-Prozesse und Wahrnehmungs-Erfahrungen erzeugt wurde, und die
z.B. als Referenz-Muster für das Ereignis "Nadelstich" dient. Wenn
eine neu erworbene Td-Fußstapfensequen - die durch gegenwärtige
Charakteristiken der Vesikel- Ansammlung und andere signifikante
zeitabhängige Parameter bestimmt wird - ungefähr mit dieser
bestehenden T'-Fußstapfenfolge (oder mit einem Teil davon!) Schritt
hält, dann wird in der synaptischen Struktur "Kovarianz" erkannt.
Dies resultiert in der Öffnung einer Vesikel- Andockstelle am
synaptischen Gitter und in der Freisetzung aller in einem Vesikel
enthaltenen Transmitter-Moleküle, worauf ein EPSP an der
sub-synaptischen Membran 25 produziert wird. Das Potential eines
EPSP entspricht jenen in Fig. 3f gezeigten
Wahrscheinlichkeitsdichte-Parametern, die für die momentan
bewertete Kovarianz signifikant sind. Wenn solche
Wahrscheinlichkeitsdichte-Parameter sich innerhalb eines bestimmten
Zeitintervalls zu einem bestimmten Schwellwert-Potential 27
addieren, wird ein AP 26 produziert. Dieses AP dient als
Bestätigung für das Ereignis " Nadel erkannt", und ruft einen
Muskel-Reflex hervor.
Der Vergleich aktueller
Verstreichzeitmuster mit früher erfassten Verstreichzeitmustern, wie
er in Fig. 3g gezeigt wird, findet in der Synapse fortgesetzt
statt. Jede erkannte Kovarianz einer neuen Zeitsequenz, die
durch besagte "zeitliche Auto-Adaption" registriert wird, setzt
eine Art von "Andock-Mechanismus" in Gang. Er initiiert jenen
Prozess, der vom Patentanmelder als "motorische Auto-Adaption"
bezeichnet wird, und welcher als der eigentliche "Motor" in
biologisch-chemischen Organismen bzw. Lebensformen verstanden werden
kann. Strukturen zeitlicher und motorischer Autoadaption, die auf
STQ-Quantisierung beruhen, existieren auch auf unterster
molekularer Ebene. Ohne Verstreichzeit-gestützte molekulare
Regelkreise wären koordinierte Zustandsveränderungen in
biologischen Systemen unmöglich. Dies trifft insbesondere auf
Bewegungen von Proteinen, auf die Erkennung und Kopierung des
genetischen Codes, und auf andere grundlegende Lebensprozesse zu.
Der Schaffung höherer biologisch/chemischer Ordnungen und komplexer
Systeme wie Synapsen oder Neurone geht die Existenz einer
STQ-quantisierenden molekularen Substruktur voraus, aus der einfache
Erkennungs- und Selbstorganisations-Prozesse von niedrigerem Niveau
abgeleitet werden. Tatsächlich gibt es unzählige Hierarchien von
auto-adaptiven Phänomenen auf verschiedenen Ebenen. Einfache
Phänomene auf molekularer Basis sind z.B. auch: das "Andocken" an
Rezeptormolekülen, die Bildung von Poren, Ionenkanälen und
subaxonalen Transportstrukturen (Mikrotubuli), und die Formierung
neuer Synapsen und axonaler Verzweigungen.
Demgegenüber
stellt die in der Beschreibung zu Fig. 4a - c gezeigte Erkennung von
Reiz- Signalverläufen durch synaptischen Zeitmuster-Vergleich (als
vegetativer Reflex oder als bewusste Wahrnehmung) ein Epiphänomen
bezüglich dessen dar. Jedes derartige auto-adaptive STQ-Epiphänomen
wird seinerseits von höherrangigen STQ- Epiphänomenen überlagert;
ein Beispiel dafür ist die Analyse komplexer
"Zeitmuster-Landschaften" auf Isomorphität. STQ- Epipänomene wie
Regelung des Wachstums, des Kreislaufes, der Körpertemperatur, der
Atmung, des Stoffwechsels, des Sehens, des Hörens, des Tastens, des
Riechens, der Bewegungskoordination usw. werden ihrerseits wieder
von noch komplexeren STQ-Szenarien übertroffen, wozu unter anderem
das Bewusstsein, das Denken, der freie Wille, das bewusste Handeln
oder auch die bewusste Zeitempfindung des Organismus zählen. In
allen diesen Fällen forscht das zentrale Nervensystem nach
konvergenten Zeitmustern, die wie einzelne Puzzle-Stücke zu einem
integrierten sensorischen Gesamtszenario zusammengesetzt werden.
Findet sich in irgendeiner Hierarchie innerhalb einer gewissen
"Latenzzeit" trotz intensiver "Suche" für eine Td-Sequenz kein
konvergentes Sub-Zeitmuster, so zeigt der Organismus chaotisches
Verhalten. Dieses Verhalten beschränkt sich auf jenen Teilbereich,
in dem der Kollaps aufgetreten ist. Sobald ein kovariantes
Zeitmuster gefunden ist, kehrt der geordnete Prozess der zeitlichen
und motorischen Auto-Adaption (und Auto-Emolution) zurück. Dies ist
auf triviale Weise mit einer Servolenkung vergleichbar, die
kurzfristig ausfällt. Das chaotische Verhalten wird jedoch ebenfalls
in seinem Ablauf als STQ-Zeitmuster quantisiert und in den
involvierten Synapsen auf eine Weise registriert, dass es trotz
einströmender AP's zu keiner Freisetzung von
Neurotransmitter-Substanzen kommt. Über subaxonale
Transportstrukturen (sog. Mikrotubili) strömen solche Informationen
als Transmittermoleküle in inverser Richtung entlang des Axons
zurück. Mikrotubili dienen zur Schaffung neuer Synapsen, und zur
synaptischer Anbindungen an solche Neuronen und neuronalen Netze, in
denen ebenfalls ein Kollaps eines Autoadaptionsprozesses aufgetreten
ist. Der Produzierung neuer Synapsen geht die Entstehung von
Dendriten voraus; das sind axonale Fortsätze, die aus Neuronen
hervorsprießen. Auf diese Weise regeneriert sich der auto-adaptive
neuronale "Feedback"- Mechanismus von selbst, und jenes
STQ-Zeitmuster, das während des kurzfristigen "chaotischen
Verhaltens" erfasst wurde, wird zu einer neuen Referenzbasis für
künftige Ereignisse. Auf diese Weise lernt der zentrale Nervensystem
(ZNS), neue Ereignisse und Erfahrungen zu registrieren; und neue
Zeitmuster einzubeziehen, die vorher unbekannt waren.
Fragen dazu bitte richten an: info@sensortime.com